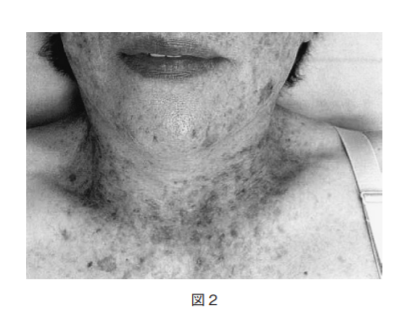
問題12.69歳の日本人女性.10歳頃から顔面にそばかすのような小色素斑がみられ,適宜サンスクリーンを使用していたが,色素斑は徐々に増加している(図2).50歳以降,3度にわたり顔面に生じた基底細胞癌の切除術を受けている.手背・足背に皮疹はなく,神経学的な異常はない.患者細胞を用いた検査で予想される結果として最も考えられるのはどれか.
1. CS遺伝子に変異が同定される.
2. 遺伝学的検査では確定診断できない.
3. 紫外線感受性試験で細胞の生存率はきわめて低い.
4. 紫外線照射後のRNA合成回復能(RRS)は低下する.
5. 紫外線照射後の不定期DNA合成能(UDS)は正常である.
普段の外来ではほとんど目にしない「色素性乾皮症(XP:Xeroderma pigmentosum)」に関する出題です。
ただ、専門医試験では、2018年度第7問、2015年度第6問、2013年度第5問でも出題されており頻出問題となっています。
出題の内容もオーバーラップしているものが多くポイントを絞った対策が可能です。
第12問 色素性乾皮症【解答:5】

本問を含め、専門医試験で問われる内容は、
「原因遺伝子の機能」
「診断のための検査」
「日本で多い病型(XPA/XPV)の特徴」
に集約されます。
珍しい疾患であるにもかかわらず、これほど何度も出題されるのには訳があります。
実は疫学調査が行われた地域の中では、色素性乾皮症の日本での発症率が2万人に1人と海外に比べて非常に高いという報告があるためと考えられます。(米国は25万人に1人、西欧は230万人に1人、Lehmann, Alan R., David McGibbon, and Miria Stefanini. “Xeroderma pigmentosum.” Orphanet journal of rare diseases 6.1 (2011): 1-6.)
出題のポイントをそれぞれ考察していきます。
原因遺伝子の機能【遺伝子の修復に問題があります】

上図は、紫外線によるDNA損傷を修復する流れを表しています。「色素性乾皮症」はXPA-XPG、XPVの8病型に分類されています。
XPA-XPGは「ヌクレオチド除去修復(NER)」というDNA修復にかかわる遺伝子変異が原因で、XPVはNERのあとに必要な「損傷乗り超え複製」の異常です。
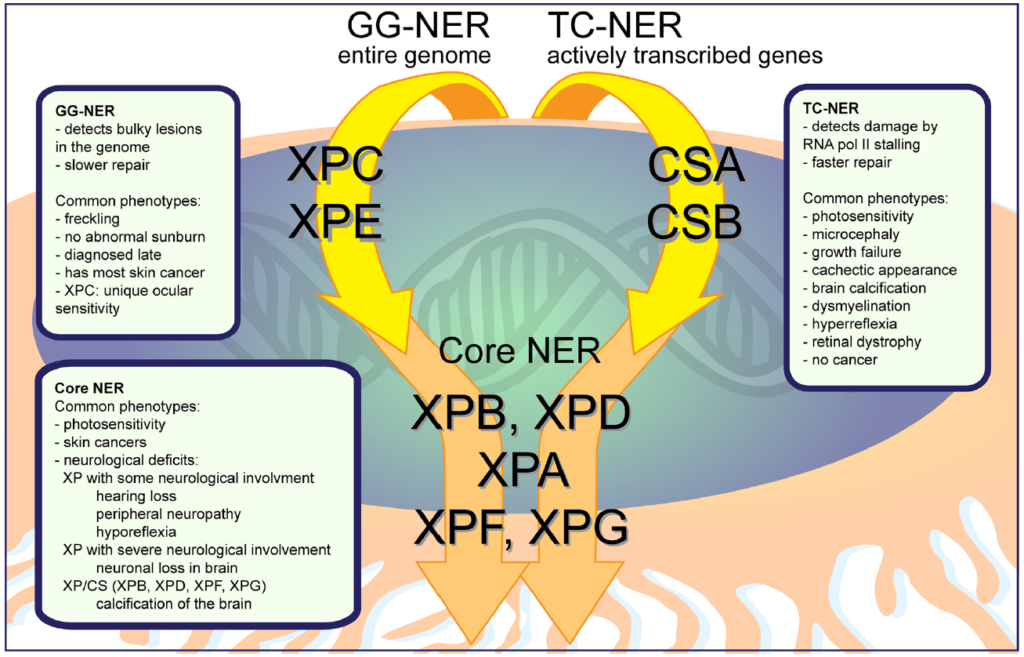
ヌクレオチド除去修復(NER)には経路が2つ(GG-NERとTC-NER)あり、Core NERという共通の経路を経てDNA修復をおこないます。経路によって病型が変わります。
- GG-NER:XPC/XPE(色素異常型)
- Core NER:XPA/XPB/XPD/XPF/XPG(サンバーン増強型)
- 損傷乗り超え複製:XPV(色素異常型)
※TC-NER:CSA/CSB→コケイン症候群(光線過敏はあるが、皮膚腫瘍は特徴ではない)の原因遺伝子
「C・E・V」のみ色素異常型で、それ以外はサンバーン増強型、と覚えておくと便利です。
診断のための検査【UDSが大切(RRS・RDSとの違い)】

「UDS・RRS・RDS」は、「細胞が紫外線照射を受けたあとのDNAやRNAの合成」を正常細胞と比べる検査です。
このうち、UDS(不定期DNA合成能)は「色素性乾皮症」診断のゴールデンスタンダードとされており最も重要です。(Lehmann, Alan R., David McGibbon, and Miria Stefanini. “Xeroderma pigmentosum.” Orphanet journal of rare diseases 6.1 (2011): 1-6.)
次の表では「紫外線照射したら正常細胞ならDNA/RNAの合成できるけど、色素性乾皮症やコケイン症候群ではそれができない」というのを難しく説明しています。
対策としては「それぞれの疾患でどのように変化するか」、が大切です。
| XPV | XP (A-G) |
コケイン症候群 | ||
| UDS (unscheduled DNA synthesis 不定期DNA合成能) |
紫外線照射直後のS期以外のDNA合成(NERによる修復)をあらわし、 S期以外のチミジン取り込み顆粒を正常細胞と比較して得られる割合 |
正常 | 低下 | 正常 |
| RRS (recovery of RNA synthesis RNA合成回復能) |
紫外線照射から23時間後のRNA合成(CSA/CSBが関与)をあらわし、 ウリジン取り込み顆粒を正常細胞と比較して得られる割合 |
正常 | 低下 | 低下 |
| RDS (replicative DNA synthesis 複製のためのDNA合成能) |
紫外線照射から6時間後のDNA合成(S期のもの)をあらわし、 S期のチミジン取り込み顆粒を正常細胞と比較して得られる割合。 |
低下 | 低下 | 低下 |
ややこしいのは、
「XPVだけがUDSの低下がなく、正常細胞と区別しにくい」
という点で、診断のために色々工夫されています。
- カフェインを混ぜて検査をすると、XPVでもUDSが低下する。(正常細胞はカフェインありでも合成OK)
- RDSという項目ではXPVで低下する。(RDSは広く行われている検査ではないようです。)
(Itoh, Toshiki, Tomomichi Ono, and Masaru Yamaizumi. “A simple method for diagnosing xeroderma pigmentosum variant.” Journal of investigative dermatology 107.3 (1996): 349-352.)
また、紫外線致死感受性試験(コロニー形成法)も検査として行われます。
紫外線照射での細胞致死(生存数が37%となる)のに必要な照射量を計測しますが、XPVはこちらも正常細胞と同等となっています。(こちらもカフェイン添加で正常細胞より感受性が高まります。)
そのほかの検査としては、「遺伝子変異を直接同定する検査」や、XPA-XPVの遺伝子を導入して導入後のDNA修復能をみる「遺伝性相補性試験」があります。
日本で多い病型の特徴【日本ではXPAが55%、XPV25%です】
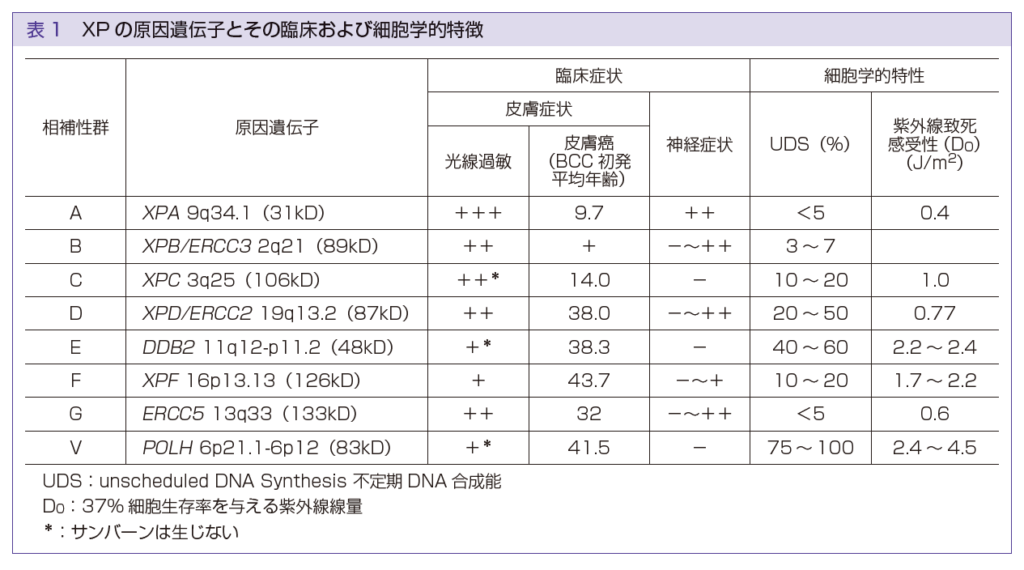
色素性乾皮症(XP)は、XPA-XPG、XPVの8病型に分かれています。
「C・E・V」が色素異常型で、「それ以外」はサンバーン増強型でしたね。
それぞれの特徴は以下のようになっています。
| 紫外線暴露後の 激しい日焼け反応 | 神経症状 | 雀卵斑様色素斑 | 皮膚悪性腫瘍 | |
| 色素異常型XP(C/E/V) | なし | なし | あり | 若年で発症 |
| サンバーン増強型XP(それ以外) | あり | あり | あり | 若年で発症 |
どの型でも皮膚悪性腫瘍が健常人より若年で発症します。
発症時期については諸説あります。
海外の報告では、色素異常型XPがサンバーン増強型XPに比べて早期に皮膚悪性腫瘍を発症するという報告があります。(Bradford, Porcia T., et al. “Cancer and neurologic degeneration in xeroderma pigmentosum: long term follow-up characterises the role of DNA repair.” Journal of medical genetics 48.3 (2011): 168-176.)
この報告では、「サンバーン増強型」では症状が激しく診断が早期に行われるためサンスクリーンを早期に導入できるために皮膚悪性腫瘍の発症が遅くなる、という考察がされています。
一方、日本の報告では、XPA(サンバーン増強型)とXPC(色素異常型)で早期に発症すると報告されています。(TAKEBE, Hiraku, Chikako NISHIGORI, and Yoshiaki SATOH. “Genetics and skin cancer of xeroderma pigmentosum in Japan.” Japanese Journal of Cancer Research GANN 78.11 (1987): 1135-1143.)(Nakano, Eiji, et al. “The present status of xeroderma pigmentosum in Japan and a tentative severity classification scale.” Experimental dermatology 25 (2016): 28-33.)
日本と海外で病型の比率が異なることも影響しているかもしれません。
専門医試験としては、
「特に修復能の低いA群・C群では10 歳前後で皮膚癌が生じている」
(日皮会誌:117(1),15―22,2007 皮膚科セミナリウム 第22 回高発癌性皮膚疾患:遺伝と皮膚癌 1.色素性乾皮症 錦織千佳子)
とあるように、
「XPA/XPCでは皮膚悪性腫瘍の発症がとくに早期に生じる」
と覚えておいて間違いなさそうです。
本問の診断:XPV
本問については、
- 色素異常型(XPC/XPE/XPV)
- 50歳以降で皮膚悪性腫瘍出現(XPA/XPC以外)
- 日本人(XPA/XPVが多い)
という特徴から、XPVが最も可能性が高いと考えられます。
XPVの特徴である「5. 紫外線照射後の不定期DNA合成能(UDS)は正常である.」が正答と考えられます。
参考文献

いかがでしたか?
細かいDNA修復過程はなるべく省略して説明するようにこころがけました。
今回の考察で、過去問にも対応できるようにまとめていますのでぜひ参考にしてください。
- 日皮会誌:120(9),1861―1867,2010 皮膚科セミナリウム 第63回高発癌性皮膚疾患(遺伝と皮膚癌)1.色素性乾皮症 森脇真一
- Weon, J. L., and Donald A. Glass. “Novel therapeutic approaches to xeroderma pigmentosum.” British Journal of Dermatology 181.2 (2019): 249-255.
- Itoh, Toshiki, Tomomichi Ono, and Masaru Yamaizumi. “A simple method for diagnosing xeroderma pigmentosum variant.” Journal of investigative dermatology 107.3 (1996): 349-352.
- Lehmann, Alan R., David McGibbon, and Miria Stefanini. “Xeroderma pigmentosum.” Orphanet journal of rare diseases 6.1 (2011): 1-6.
- 日本皮膚科学会 色素性乾皮症診療ガイドライン2015
- Bradford, Porcia T., et al. “Cancer and neurologic degeneration in xeroderma pigmentosum: long term follow-up characterises the role of DNA repair.” Journal of medical genetics 48.3 (2011): 168-176.
- TAKEBE, Hiraku, Chikako NISHIGORI, and Yoshiaki SATOH. “Genetics and skin cancer of xeroderma pigmentosum in Japan.” Japanese Journal of Cancer Research GANN 78.11 (1987): 1135-1143.
- Nakano, Eiji, et al. “The present status of xeroderma pigmentosum in Japan and a tentative severity classification scale.” Experimental dermatology 25 (2016): 28-33.
最後に、こんな風に考えたら答えがかわるかもしれない、というご意見がありましたら、
ぜひコメント・ご意見いただけると嬉しいです。



コメント