問題22.家族性寒冷蕁麻疹,Muckle-Wells 症候群,CINCA症候群に共通する原因遺伝子はどれか.
1. IL36RN
2. LPAR6
3. NF1
4. NLRP3
5. NOD2
自己炎症性疾患は、ここ数年あまり出題がみられていない分野です。
ですが、皮膚科関連では、蕁麻疹などの「皮疹」+α、といったかたちで発症することがあり、小児科などからのコンサルトを受けて、適切な医療機関の受診を案内することが皮膚科医として求められます。
本問はclassicalな自己炎症性疾患の出題ですが、「自己炎症性角化症」という新しい疾患概念も日本から提唱されています。
自己炎症性角化症は、「膿疱性乾癬(汎発型)・家族性毛孔性紅色粃糠疹・familial keratosis lichenoides chronica」をまとめた概念で、2020年第18問に関連遺伝子(IL36RN/CARD14)の出題がありました。
自己炎症性疾患は2021年度皮膚科学会総会の必須講習会でも取り上げられており今後の出題に注目です。
ただ、残念ながらこれまでの日本皮膚科学会雑誌などのセミナリウムなどで自己炎症性疾患について解説された文献は見当たりませんでした。
というわけで、この記事では、「自己炎症性疾患」の分類について
Textbook of autoinflammation. Vol. 10. Springer International Publishing, 2019.
という文献をもとにまとめています。
この記事では、今後の出題に備えて
- 自己炎症性疾患の分類は?
- インフラマソームってなに?
- プロテアソームってなんで関係あるの?
といった内容を解説しています。
第22問 クリオピリン関連周期熱症候群(CAPS)の原因遺伝子【解答:4】

本問で出題されている3つの疾患は「クリオピリン関連周期熱症候群(CAPS)」として知られていて、いずれもNLRP3の機能獲得変異によって生じます。
というわけで回答は、4となるわけですが、それだけでは今後の出題には対応できそうにありません。
自己炎症性疾患は、1999年に提唱された新しい概念です。
病態については2000年代に入ってからIL-1阻害薬の開発とともに研究が進みました。
最初のIL-1阻害薬の報告は2008年のリロナセプト(国内未承認)で、医学生時代の教科書レベルでは病態の整理がされていなかったように思います。
自己炎症性疾患の分類【今のところ基本は6つ】

| 関連サイトカイン・病態 | 疾患 | |
| 1 | IL-1 | 家族性地中海熱(FMF) TNF受容体関連周期性症候群(TRAPS) クリオピリン関連周期熱症候群(CAPS) 高IgD症候群(HIDS)/メバロン酸キナーゼ欠損症(MKD) |
| 2 | Ⅰ型インターフェロン | 中條・西村症候群(CANDLE症候群) エカルディ・グティエール症候群(AGS) |
| 3 | IL-18 マクロファージ活性化症候群 | NLRC4異常症 |
| 4 | IL-23/IL-17/IL-36 | IL-36受容体拮抗因子欠損症(DITRA) CARD14関連乾癬(CAMPS) |
| 5 | NF-κB/ユビキチン化 | A20ハプロ不全症(HA20) ADA2欠損症(DADA2) |
| 6 | NF-κB/肉芽腫 | ブラウ症候群 |
Textbook of Autoinflammationでは主な病態別の分類として自己炎症性疾患を6つに分けています。
今回は指定難病に指定されている自己炎症性疾患(PAPA症候群は指定難病ですが分類が難しいので除いています)について、その分類を示しました。(CAMPSは2021年6月現在難病指定なし)
2014年度以降の皮膚科専門医試験では、2019年の2問と2020年の1問のみで、表の太文字の疾患が選択肢として出題されています。(そのほか、自己炎症性角化症として提唱されているfamilial keratosis lichenoides chronicaのNLRP1遺伝子も出題されています。)
まずは、出題歴のある太文字の疾患から理解していくのが良いと思います。
分類を理解するには、
「そもそも自己炎症性疾患ってなに?」
という点をおさえておくことが大切です。
以下、「自己炎症性疾患」とその理解に必要な「パターン認識受容体・インフラマソーム・タンパク質ホメオスタシス」について解説しています。
この記事では各疾患については細かく解説していませんが、「パターン認識受容体・インフラマソーム・タンパク質ホメオスタシス」について知っていると各疾患の理解が進むように思います。
自己炎症性疾患の定義【自己炎症性疾患は「自然免疫」の異常です】

Textbook of Autoinflammationによると自己炎症性疾患は
自己抗体や自己反応性T細胞といった自己免疫性疾患の特徴を欠き、
誘発因子なく炎症を起こす疾患群
と定義され「自然免疫」を中心とした異常を持つ疾患群とされています。
病態分類には、次の2種のサイトカインが重要です。
IL-1ファミリー:IL-1β・IL-18・IL-36Ra
Ⅰ型インターフェロン:IFN-α・IFN-β
※NF-κB活性化はIL-1ファミリー・Ⅰ型インターフェロンの産生につながる。
多くの自己炎症性疾患は、この2種のサイトカイン産生につながる自然免疫系の経路の異常によって起こります。
そのため自己炎症性疾患の理解には、
「Toll-like受容体」などの異物を認識するパターン認識受容体(PRR)
IL-1ファミリー産生につながる「インフラマソーム」
細胞内に蓄積した蛋白が異物と認識されないための「タンパク質ホメオスタシス」
といった自然免疫系の理解が必要です。
パターン認識受容体・インフラマソーム・タンパク質ホメオスタシス

- パターン認識受容体(PRR):細菌などの異物の認識し自然免疫を活性化。
- インフラマソーム:PRRによる異物認識後に形成される複合体。IL-1βなどのサイトカイン産生。
- タンパク質ホメオスタシス:異常なタンパク質が蓄積するとPRRによって認識され炎症を惹起する。正常では、タンパク質は生成後、余分なものは処理されている。
- プロテアソーム・オートファジー:異常なタンパク質などを処理し、PRRによる認識を防ぐ。
「適応免疫」では病原体への特異性が特徴的ですが、
「自然免疫」でも病原体や異物に共通するパターンを認識する受容体によって対象を認知し免疫反応が進むことが明らかになっています。
パターン認識受容体(PRR)【主なものはTLRとNLRの2種類】
パターン認識受容体(PRR)による異物の認識から「自然免疫」は始まります。
異物とされる対象は主に2種類で、PAMPsやDAMPsと呼ばれます。
※PAMPs:病原体(細菌・ウイルスなど)のタンパク質・核酸の一部。LPSなど。
※DMAPs:壊れたヒトの細胞のタンパク質・核酸の一部。ATPや尿酸など。
PRRが対象を認識した後は、NF-κBなどの転写因子が活性化されIL-1βの前駆体・Ⅰ型インターフェロンなどの産生につながります。
また、後述する「インフラマソーム」の形成を促す点も重要です。
主なPRRはTLRとNLRの2種類です。
TLR(Toll like receptor)
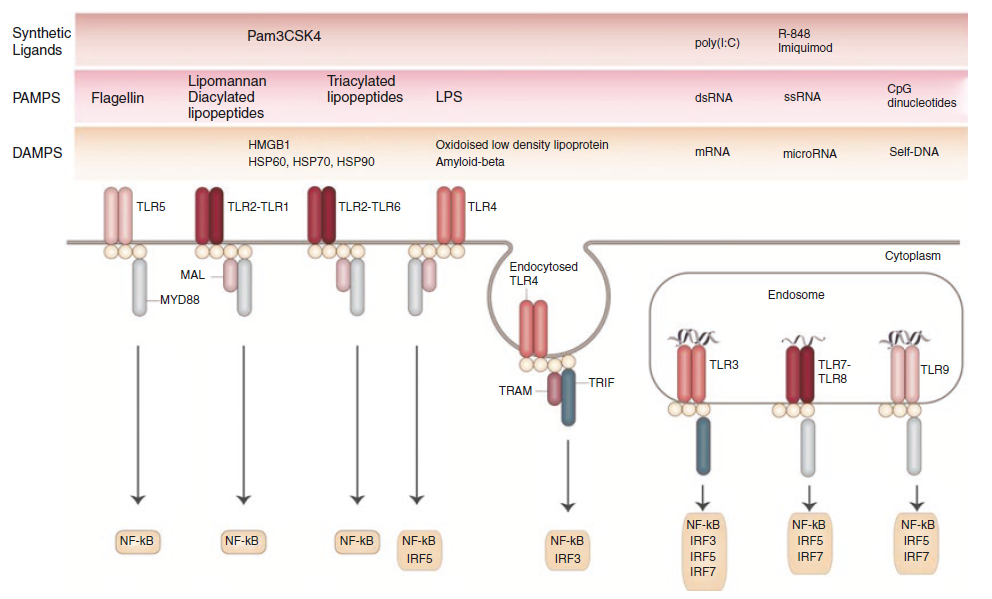
「細胞表面」に位置するものと「エンドソーム内」に位置するものがあり、それぞれ認識対象が異なっています。
たとえば、皮膚腫瘍などに使用される「イミキモド」はTLR7に認識されます。
いずれのTLRでも対象認識により主にNF-κB・IRF(インターフェロン制御因子)の活性化が起こり炎症反応が始まります。
| 部位 | 認識対象 | |
| TLR1 TLR2 TLR6 TLR10 | 細胞表面 | PAMPsなど |
| TLR4 | 細胞表面 | LPS |
| TLR5 | 細胞表面 | Flagellin |
| TLR3 | エンドソーム内 | dsRNA |
| TLR7 TLR8 TLR9 | エンドソーム内 | 核酸 |
NLR(NOD like receptor)
細菌の細胞壁などを認識する細胞質の蛋白質で、NOD1/NOD2などがあり、こちらもNF-κBの活性化を誘導します。
NOD1/NOD2以外のNLRは次で説明する「インフラマソーム」の部品として対象を認識する役割を果たします。
インフラマソーム【センサー蛋白+アダプター蛋白+カスパーゼ1】
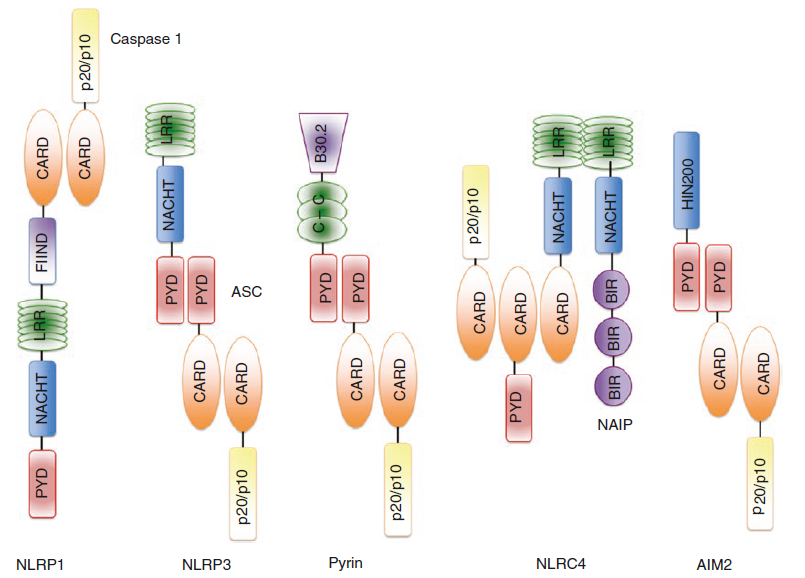
「インフラマソーム」=「センサー蛋白」+「アダプター蛋白」+「カスパーゼ1」
「インフラマソーム」は、PRRによる異物認識後に細胞質で形成される蛋白質の複合体です。
主にIL-1β産生亢進(一部NF-κB活性化)に寄与します。
大きく分けると「NLR:NOD-like receptor」と「ALR:AIM2-like recepter」2種類のセンサー蛋白ファミリーが存在し、センサー蛋白によってインフラマソームの名称がついています。
| センサー蛋白の種類 | 主なインフラマソームの種類 |
| NLR | NLRP1・NLRP3・NLRP6・NLRP7・NLRP12・NLRC4 |
| ALR | AIM2・IFI16 |
このほか、家族性地中海熱の原因として知られる「pyrinインフラマソーム」も重要です。
インフラマソームを構成する部品のそれぞれの役割は以下の通りです。
- センサー蛋白:PRRと同様に異物を認識
- アダプター蛋白(ASC蛋白):「センサー蛋白」と「カスパーゼ」をつなぎ、カスパーゼ1を活性化。
- カスパーゼ1:IL-1βやIL-18の前駆体からIL-1β・IL-18を生成
インフラマソームの活性化はIL-1βなどのサイトカイン産生につながるため、「インフラマソームの異常な活性化が自然免疫を起こす」、というのは理解しやすいですね。
本問のクリオピリン関連周期熱症候群(CAPS)は、
「NLRP3遺伝子の機能獲得変異によりNLRPインフラマソームが異常に活性化され自然免疫が賦活化される疾患」というわけです。
タンパク質ホメオスタシス【プロテアソームとオートファジー】
「タンパク質ホメオスタシス」とは、
「生成されたタンパク質をきちんと処理する」過程
を指します。
生成されたタンパク質には誤って折りたたまれたりした欠陥品(misfolded protein)が混ざっていることがあり、処理されずに蓄積すると、炎症を惹起します。
細胞がタンパク質を処理する過程は「プロテアソーム」による処理と「オートファジー」による処理の主に2種類です。
- プロテアソーム:ユビキチン蛋白で修飾された欠陥蛋白を分解する
- オートファジー:傷つき老化した細胞内小器官などを脂質膜でつつみリソソームと結合することで分解する
「オートファジー」による処理は、ミトコンドリアなどの細胞内小器官の処理にもかかわるので、「プロテアソーム」による処理よりも規模が大きいイメージですね。
自己炎症性疾患では「プロテアソーム」による分解の異常により発症するものの研究がすすんでいます。
プロテアソームの異常により欠陥蛋白が蓄積すると、
Ⅰ型インターフェロン優位の炎症
を惹起することが明らかになっています。
その代表的な疾患が「中條・西村症候群」で、2019年度の第67問に出題があります。
また、Ⅰ型インターフェロンのシグナルはJAKを介して伝わるため、バリシチニブ(オルミエント)などのJAK阻害薬による治療報告もされており今後の臨床応用が注目されています。
まとめ

| 関連サイトカイン・病態 | 疾患 | |
| 1 | IL-1 | 家族性地中海熱(FMF) TNF受容体関連周期性症候群(TRAPS) クリオピリン関連周期熱症候群(CAPS) 高IgD症候群(HIDS)/メバロン酸キナーゼ欠損症(MKD) |
| 2 | Ⅰ型インターフェロン | 中條・西村症候群(CANDLE症候群) エカルディ・グティエール症候群(AGS) |
| 3 | IL-18 マクロファージ活性化症候群 | NLRC4異常症 |
| 4 | IL-23/IL-17/IL-36 | IL-36受容体拮抗因子欠損症(DITRA) CARD14関連乾癬(CAMPS) |
| 5 | NF-κB/ユビキチン化 | A20ハプロ不全症(HA20) ADA2欠損症(DADA2) |
| 6 | NF-κB/肉芽腫 | ブラウ症候群 |
自己炎症性疾患で大切なサイトカインは、「IL-1ファミリー」と「Ⅰ型インターフェロン」でした。
そして「NF-κB」はその両者の産生につながります。
表をあらためてみると、
1と3はともに「IL-1ファミリー」が関連する疾患群です。
2は「Ⅰ型インターフェロン」が関連します。
4は「IL-1ファミリー(DITRA)」・「NF-κB(CAMPS)」の異常が関係しています。
5と6は「NF-κB」の異常です。
今回の分類は、すべての自己炎症性疾患を網羅できるわけではありませんが、メジャーどころの疾患は含まれていると思います。
この記事を読んで「とっつきにくい」自己炎症性疾患の理解に、少しでもお役に立てていれば幸いです。
参考文献

- Akiyama, Masashi, et al. “Autoinflammatory keratinization diseases.” Journal of Allergy and Clinical Immunology 140.6 (2017): 1545-1547.
- Hashkes, Philip J., Ronald M. Laxer, and Anna Simon, eds. Textbook of autoinflammation. Vol. 10. Springer International Publishing, 2019.
- Canna, Scott W., and Raphaela Goldbach-Mansky. “New monogenic autoinflammatory diseases—a clinical overview.” Seminars in immunopathology. Vol. 37. No. 4. Springer Berlin Heidelberg, 2015.
- Sanchez, Gina A. Montealegre, et al. “JAK1/2 inhibition with baricitinib in the treatment of autoinflammatory interferonopathies.” The Journal of clinical investigation 128.7 (2018): 3041-3052.
最後に、こんな風に考えたら答えがかわるかもしれない、というご意見がありましたら、
ぜひコメント・ご意見いただけると嬉しいです。
←前問題 2019年度 第21問 アトピー性皮膚炎でケラチノサイトが産生するサイトカイン



コメント