問題30.1 歳のアトピー性皮膚炎患児に投与可能な薬剤(添付文書に6 か月児以上の用法用量が記載され,安全性が確立していないことの注意記載がない)はどれか.2 つ選べ.
1. アレジオンⓇドライシロップ
2. クラリチンⓇドライシロップ
3. ザイザルⓇシロップ
4. ザジテンⓇドライシロップ
5. ジルテックⓇドライシロップ
第二世代抗ヒスタミン薬の添付文書に関する出題です。
抗ヒスタミン薬ってたくさんありますよね。全部使いこなせていますか?僕は一部のものしか使いませんし、すべて使う必要はないと思っています。
なので、普段使わない薬は毎回添付文書をみてから処方しますし、みなさんも同じですよね??
正直、「抗ヒスタミン薬の細かい注意なんて毎回確認すればいいじゃん!」
と思っているのですが、皮膚科専門医になるには、そうにもいかないようです。
皮膚科専門医試験での出題は「アトピー性皮膚炎診療ガイドライン2018」で抗ヒスタミン薬についてまとめられていることを受けてのことと考えられます。実際、2013~2017年度には抗ヒスタミン薬の添付文書に関する出題はありませんでした。
2018年度の第86問では「慎重投与に腎機能障害の記載がない抗ヒスタミン薬」を回答する出題があり、つづく2019年度は本問の出題となっています。2020年度は同様の出題はありませんでしたが、今後も出題が予想されます。
後述するようにアトピー性皮膚炎への抗ヒスタミン薬投与の有効性については議論がありますが、専門医試験は割り切って暗記するしかありません。
この記事では、おもに第二世代抗ヒスタミン薬の「小児の投与可能時期」、「禁忌」、「妊婦・授乳婦」、「腎障害・肝障害患者」、「運転上の注意」といったの使用上の注意についてまとめています。
<この記事での小児の投与可能時期の解釈>
本問の定義に準じて、「添付文書で『具体的な時期の用法用量の記載』があり『安全性が確立されていない』・『臨床試験がおこなわれていない』旨の表記がない月齢・年齢」を使用しています。
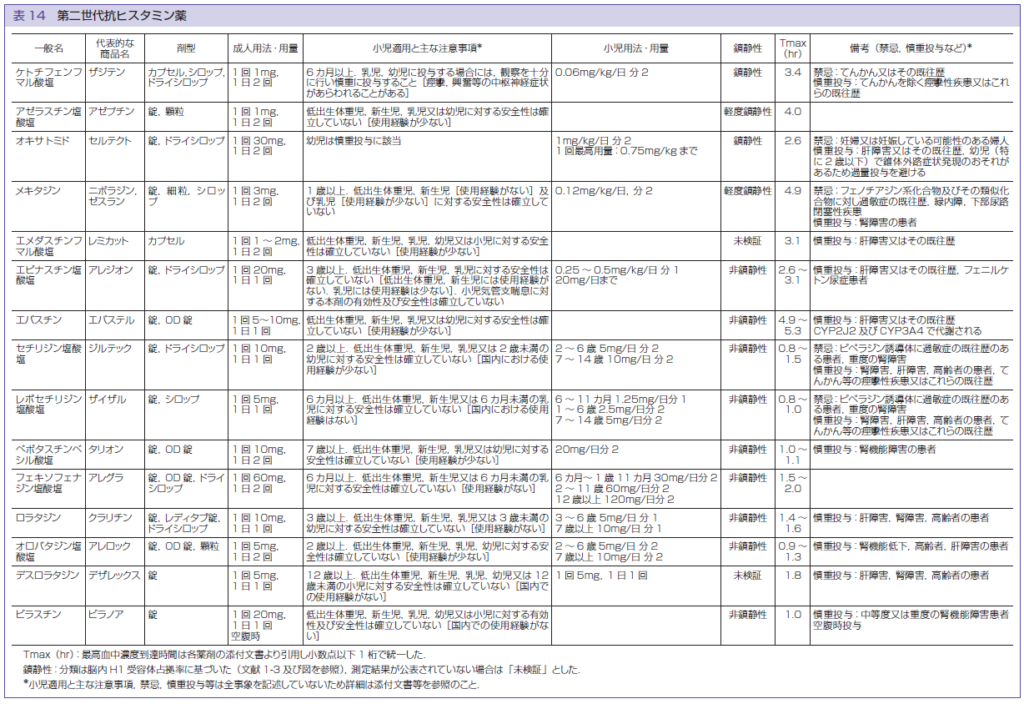
第30問 第二世代抗ヒスタミン薬の投与可能時期【解答:3・4】
第二世代抗ヒスタミン薬っていくつあるか知っていましたか?
「アトピー性皮膚炎診療ガイドライン2018」に記載されているのが15個でこれにルパフィン®を加えて、なんと16個もあるんですよね。
16個の添付文書を丸暗記するなんていうのはなかなか苦行なので、出題されやすい項目ごとにまとめてみました。
投与可能時期は上図の通りです。
添付文書上の記載の関係でアゼプチン®とセルテクト®(オキサトミド)は投与開始時期を示していません。(気になる方は 後述の「添付文書の解釈」を参考にしてみてください。)
ちなみに剤形については、
| 投与可能時期 | 剤形 |
| 6か月~3歳 | ドライシロップ・シロップ 細粒(ニポラジン®)・顆粒(アレロック®) |
| 7歳~ | 錠・レディタブ錠・カプセル |
となっています。
ここでもう一度注意喚起です。(あくまでこの図は皮膚科専門医試験対策とご理解ください。)
<この記事での小児の投与可能時期の解釈>
本問の定義に準じて、「添付文書で『具体的な時期の用法用量の記載』があり『安全性が確立されていない』・『臨床試験がおこなわれていない』旨の表記がない月齢・年齢」を使用しています。
これほど何度も解釈を強調するかは後述の「添付文書の解釈」の項で説明します。(専門医試験には直接関係ないので興味がある方だけどうぞ。)
第二世代抗ヒスタミン薬【禁忌、妊婦・授乳婦、肝腎機能障害、運転上の注意】

抗ヒスタミン薬の出題は、投与可能時期に留まりません。
2018年には腎機能障害患者に慎重投与の記載がない抗ヒスタミン薬を回答する出題がありました。
「禁忌」、「妊婦・授乳婦」、「腎障害・肝障害患者」、「運転上の注意」 についてまとめました。
第二世代抗ヒスタミン薬の禁忌【てんかん・妊娠・重度腎障害もあります】

過敏症はもちろん禁忌ですが、
過敏症以外の禁忌がある「ザジテン®」・「セルテクト®」・「ザイザル®」は出題しやすそうです。
抗ヒスタミン薬と妊婦・授乳婦【禁忌もあります】

「アタラックス®」・「アタラックスP®」・「セルテクト®」は妊娠禁忌です。
「アタラックス®」と「アタラックスP®」以外の第一世代抗ヒスタミン薬、「ジルテック®」、「クラリチン®」については先天異常との関連がないという報告がありますので、比較的安心して使用できる、という認識でよいと思います。
授乳については、母乳を介して子供に移行することから鎮静性を考慮して
「第二世代」>「第一世代」
という推奨になっています。
第二世代抗ヒスタミン薬と肝機能障害・腎機能障害

なんとも覚えにくいですが、
「ジルテック®(セチリジン)」・「ザイザル®(レボセチリジン)」
「クラリチン®(ロラタジン)」・「デザレックス®(デスロラタジン)」
「ルパフィン®(ルパタジン=体内で代謝されてデスロラタジン)」
は、似た者同士で「腎機能障害・肝機能障害ともに注意あり」の同じブロックに入っています。
頑張って覚えるしかないですね。
第二世代抗ヒスタミン薬の運転上の注意

ここは、先ほどの似た者同士の法則の例外があります。
「クラリチン®(ロラタジン)」・「デザレックス®(デスロラタジン)」は運転OKですが、「ルパフィン®(ルパタジン=体内で代謝されてデスロラタジン)」 は運転禁止となっています。
「運転可能」・「運転注意」は「運転禁止」と比べて数が少ないので、その二つを中心に覚えていきたいところです。
ここまで抗ヒスタミン薬の注意について説明してきましたが、そもそも「アトピー性皮膚炎」への有効性には議論がある、ということについて欧米のアトピー性皮膚炎のガイドラインを通してみてみます。
アトピー性皮膚炎への効果【第二世代抗ヒスタミン薬を積極推奨しているのは日欧米では日本のみ】

前述したように、アトピー性皮膚炎への抗ヒスタミン薬(特に非鎮静性抗ヒスタミン薬)の効果には議論があります。
実は、欧米のアトピー性皮膚炎のガイドラインではアトピー性皮膚炎への抗ヒスタミン薬は積極的には推奨されていません。
日欧米の中で抗ヒスタミン薬を積極的に推奨しているのは日本のみでアトピー性皮膚炎への抗ヒスタミン薬のエビデンスは十分とはいえないことには留意しておく必要があります。欧米での抗ヒスタミン薬の使用は「蕁麻疹」や「アレルギー性鼻炎」が中心となっています。
実際に有効ならば海外でも積極推奨されて然るべきだと思うのですが、そのようなエビデンスの蓄積もなく(有効だとする主張の多くは「アトピー性皮膚炎の治療の中心であるステロイド外用薬を併用したデータ」を引用しています。)漫然と日本で推奨されていることには疑問があります。
添付文書の解釈【2024年までに添付文書の記載要領の変更が完了】
この記事では冒頭、くどい程、次の注意を出しました。
<この記事での小児の投与可能時期の解釈>
本問の定義に準じて、「添付文書で『具体的な時期の用法用量の記載』があり『安全性が確立されていない』・『臨床試験がおこなわれていない』旨の表記がない月齢・年齢」を使用しています。
なぜ、これほど注意するのか?
冒頭の図に示した投与可能時期は皮膚科専門医試験対策用の解釈です。
しかし、解釈次第で添付文書上の投与可能時期は変わってしまいます。
たとえば「アレジオン®ドライシロップ」について考えてみると、上記の解釈による投与可能時期は「3歳以上」ですが、「1歳以上」という解釈もできてしまいます。添付文書をみてみます。


用法用量には「体重による投与量」とは別に「3歳以上での7歳未満・7歳以上での投与量」について記載されています。
一方、「小児等への投与」の欄には以下の記載があります。

添付文書上「乳児とは、生後4週以上1歳未満の児」とされています。この記載からは「1歳以上では安全性が確立されている」という理解ができるわけです。
「用法用量の具体的な時期記載(3歳以上)」がありかつ「投与の安全性が確立されている年齢(1歳以上)」は「3歳以上」です。
ただ、用法用量の欄に年齢が記載されていないからといって投与してはいけないわけではありません。
「1歳以上」であれば安全性が確立されているから体重に応じて投与量を決定すればよい、という解釈もできるわけです。(製造販売元の日本ベーリンガーインゲルハイムに問い合わせ、1歳以上で問題ないと回答を得ました。)
これが、くどい程に「投与可能時期」に関する定義を繰り返した理由です。
また、アゼプチン®は用法用量欄に具体的な年齢記載がなく、セルテクト®(オキサトミド)に至っては「小児等への投与」の欄に「○○に対する安全性は確立していない。」や「○○を対象とした臨床試験は実施していない」という表現がありません。(そのため両薬剤は図中で投与可能時期を示していません。)
こんな感じで、添付文書によって記載方法が違っているのはなかなか不便です。
そこで動いたのが厚生労働省。
「医療用医薬品の添付文書等の記載要領について」という通知を出し、添付文書の記載を統一しようと動いています。
添付文書の新記載要領【2024年までは新旧混在】
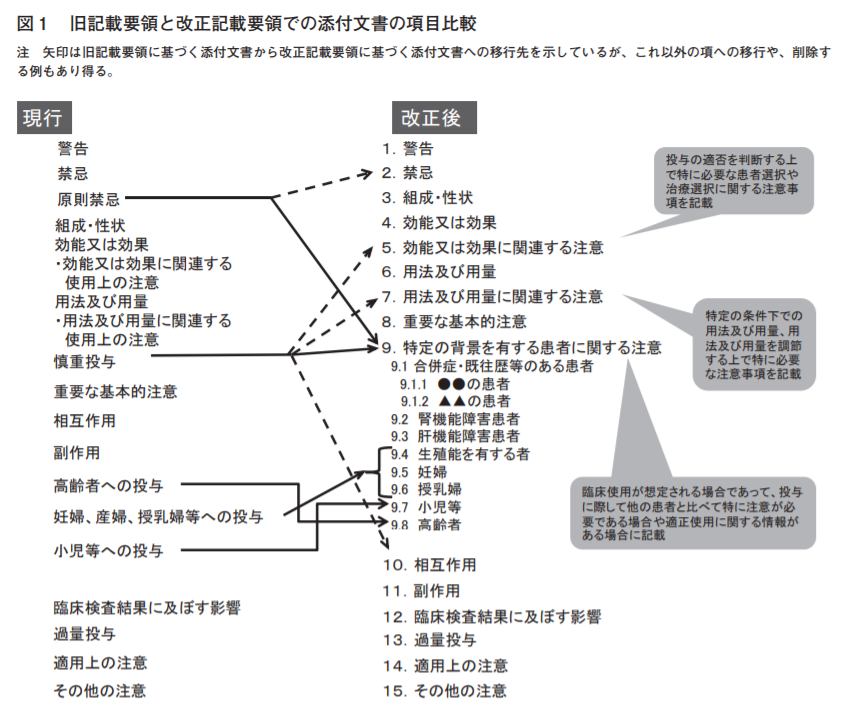
2017年に「医療用医薬品の添付文書等の記載要領について」の通知が厚生労働省から出され2019年から添付文書の様式変更が開始されました。
主な変更点は次の通りです。
- 「原則禁忌」の廃止
- 「慎重投与」の廃止
- 「高齢者への投与」「妊婦、産婦、授乳婦等への投与」「小児等への投与」の廃止
記載の場所が変わったり具体的な記載が追加される変更です。
皮膚科専門医試験で特に重要なのは3番の「小児等への投与」です。
| 旧 | 新 |
| ○○に対する安全性は確立されていない | ○○を対象とした(有効性及び安全性を指標とした) 臨床試験は実施していない |
(厚生労働省医薬・生活衛生局医薬安全対策課 平成31年1月17日)
冒頭示した「小児の投与可能時期」については「新旧の記載」を踏まえて作成しています。
今後の問題文の表現も「『臨床試験が実施されている』月齢・年齢」といった記載になるかもしれません。
2021年8月現在、小児の欄に月齢・年齢が示されていない「ザジテン®」・「セルテクト®」の記載がどうなるかは注目です。
といっても、すぐにすべての様式が統一されるわけもなく5年間の経過措置がとられるため、
「2019年4月1日~2024年3月31日」は「旧」記載要領と「新」記載要領が混ぜこぜになってしまっています。(さらにややこしい。。)
2024年以降は、添付文書にそれほど惑わされなくて済むのでそれまでの辛抱ですね。(それまでに専門医試験を受ける方は、新旧入りまじった添付文書のせいでさらに混乱です。)
参考文献

- アトピー性皮膚炎診療ガイドライン2018 日本皮膚科学会
- Wollenberg, A., et al. “Corrigendum: Consensus‐based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I.” Journal of the European Academy of Dermatology and Venereology 33.7 (2019): 1436-1436.
- Sidbury, Robert, et al. “Guidelines of care for the management of atopic dermatitis: section 3. Management and treatment with phototherapy and systemic agents.” Journal of the American Academy of Dermatology 71.2 (2014): 327-349.
- アレジオン®ドライシロップ添付文書 2015年1月改訂(第8版)
- 医療用医薬品の添付文書等の記載要領について(薬生発0608第1号 平成29年6月8日)https://www.pmda.go.jp/files/000236340.pdf
- 医薬品・医療機器等安全性情報No.344(厚生労働省 医薬・生活衛生局 2017年6月)
- 医療用医薬品の添付文書等の記載要領に関する質疑応答集(Q&A)について(厚生労働省医薬・生活衛生局医薬安全対策課 平成31年1月17日)https://www.pmda.go.jp/files/000227533.pdf
最後に、こんな風に考えたら答えがかわるかもしれない、というご意見がありましたら、
ぜひコメント・ご意見いただけると嬉しいです。
←前問題 2019年度 第29問
TNFα阻害薬の禁忌【多発性硬化症は増悪するというRCTがあります】



コメント